Fuente: Texto y fotos de la noticia extraídos de www.abc.es
Un estudio en NEJM es el primer trabajo en humanos que demuestra la posibilidad de corrección de esta enfermedad mediante la edición de ADN que añade una copia correcta del gen
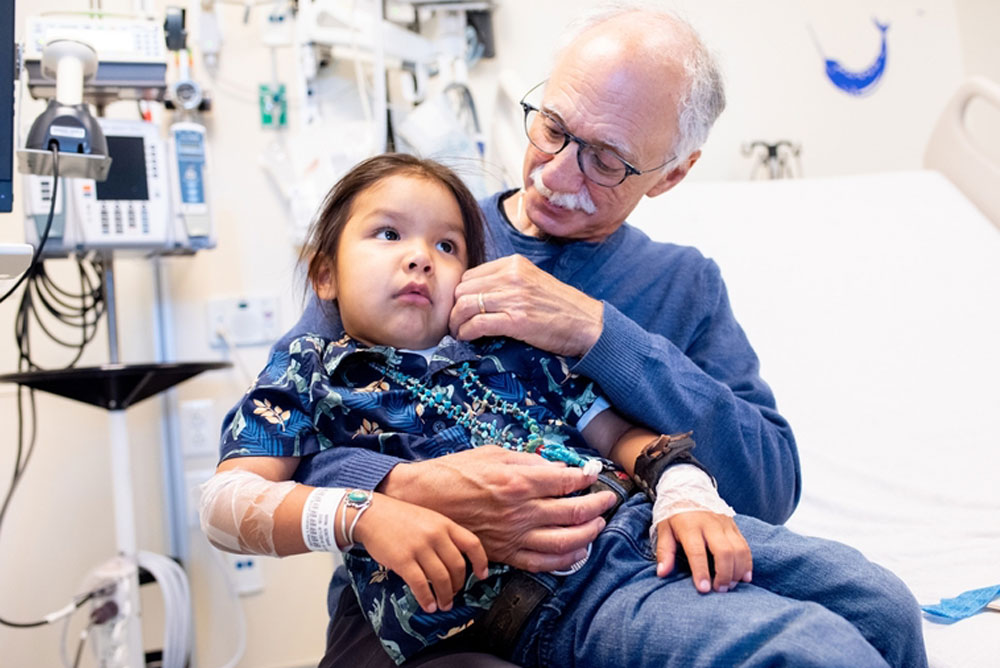
Diez niños pequeños que nacieron sin su sistema inmune funcional y carentes así de la capacidad de combatir infecciones se han beneficiado de un tratamiento de terapia génica desarrollado en la Universidad de California-San Francisco (EE.UU.).
El estudio que se publica en la revista «New England Journal of Medicine» constituye el primer trabajo en humanos que demuestra la posibilidad de corrección de esta enfermedad mediante la edición génica que añade una copia correcta del gen.
El ensayo fase I/II demuestra la seguridad y eficacia de este tratamiento para un tipo concreto de inmunodeficiencia combinada grave (IDCG), conocida como enfermedad del niño burbuja, por deficiencia de Artemis, mediante el uso de un vector lentiviral.
Los 10 niños tratados padecen Artemis-SCID, un trastorno genético muy poco frecuente que suele tratarse con un trasplante de médula ósea de un donante sano, idealmente un hermano o hermana compatibles.
La IDCG constituye una emergencia pediátrica y afecta aproximadamente a uno de cada 35.000-50.000 recién nacidos. Se trata de una enfermedad mortal sin tratamiento en los 2 primeros años de la vida por el desarrollo de infecciones, autoinmunidad o cáncer.
En EE.UU, desde diciembre de 2018 todo recién nacido se somete a una prueba de cribado rápida y fiable coincidiendo con las pruebas endocrino-metabólicas a las 48 horas de vida, permitiendo una identificación precoz de esta enfermedad, explica a Science Media Center, Luis Ignacio González Granado, médico especialista en inmunodeficiencias y profesor asociado de pediatría en la Universidad Complutense de Madrid.
La nueva terapia génica permite a los investigadores tratar a los bebés recién diagnosticados con sus propias células -añadiendo una copia sana del gen Artemis a las células madre de médula ósea extraídas del bebé, y luego infundiendo las células madre corregidas de nuevo en sus cuerpos- con la esperanza de evitar muchas de las complicaciones a corto y largo plazo del tratamiento estándar, incluida la muerte.
Para Pere Soler Palacín, del Hospital Infantil Vall d’Hebron de Barcelona, es muy relevante el hecho de que «la práctica totalidad de los pacientes incluidos se habían diagnosticado mediante cribado neonatal, por lo que se aplicó la terapia génica en pacientes libres de complicaciones de su enfermedad. Este punto refuerza aún más la importancia del binomio cribado neonatal-terapia génica en el tratamiento de estas y otras enfermedades genéticas ».
En declaraciones a SMC, Soler señala que este trabajo «suma otra IDCG al grupo de inmunodeficiencias primarias que se pueden tratar mediante terapia génica».
«El curso de su enfermedad ya es mucho mejor que con el tratamiento habitual», afirma Mort Cowan, investigador principal del ensayo, que ha tratado a más de 30 niños con Artemis-SCID mediante trasplantes de médula ósea estándar. «Nunca he visto resultados así en ninguno de los otros niños. Es asombroso».
La corrección génica se ha utilizado previamente en pacientes con otras formas genéticas de IDCG, pero su uso en la IDCG-Artemis es significativo porque estos pacientes suelen responder peor a los trasplantes de médula ósea estándar. Las complicaciones pueden ser rechazo del injerto de médula, enfermedad injerto contra huésped -en la que las células T del donante atacan los tejidos del receptor-, infecciones crónicas que dañan los órganos, retraso del crecimiento y muerte prematura.
«Que los pacientes del ensayo alcancen la inmunidad total de las células T es extraordinario. La recuperación de las células B lleva más tiempo, pero hasta ahora parece que los pacientes también tienen muchas más posibilidades de reconstitución de las células B que con un trasplante de médula ósea normal», afirma Jennifer Puck, de la UCSF. «Utilizar con éxito menos quimioterapia también es una gran victoria, ya que minimiza los efectos secundarios nocivos de la dosis completa de busulfán en bebés pequeños».
Una mejor inmunidad de las células B podría ayudar a evitar problemas como la enfermedad pulmonar crónica que suelen desarrollarse más tarde en la infancia
Una mejor inmunidad de las células B podría ayudar a evitar problemas como la enfermedad pulmonar crónica que suelen desarrollarse más tarde en la infancia en los pacientes con Artemis-SCID que reciben un trasplante de médula ósea estándar, añade Cowan.
Los niños del ensayo tienen actualmente entre 18 meses y 4,5 años; nueve nacieron en EE.UU. y fueron diagnosticados tras un cribado neonatal de IDCG; uno nació en Canadá y fue diagnosticado a los cinco meses de edad con enfermedad clínica. Cuatro pacientes son de ascendencia nativa americana Navajo/Apache, donde la mutación Artemis-SCID es más común. La mediana de seguimiento fue de 31,2 meses. En el momento de la publicación del estudio, seis pacientes habían sido seguidos durante al menos 24 meses.
«Ahora mismo somos pioneros en terapia génica en esta enfermedad tan rara, pero estamos utilizando técnicas que pueden exportarse a otras situaciones y ayudar a muchas otras afecciones en todo el mundo», afirma Puck.
¿Qué implica para los niños de nuestro país que puedan presentar esta enfermedad? se pregunta González Granado. «A pesar de que la estrategia de cribado al nacimiento —junto con el resto de las pruebas endocrinometabólicas— se ha demostrado coste efectiva, en nuestro país está únicamente implementado a nivel poblacional en Cataluña desde 2017. Varias Comunidades Autónomas han manifestado su interés o lo han implementado recientemente en su legislación como paso previo a la implementación de facto».
Ver la noticia en www.abc.es